血液淨化
血液淨化及臨床應用上的重要性
血液淨化是將血液引流至人體外,透過不同的濾器、吸附器,以擴散、對流、吸附、超濾、過濾等方式,將原本人體中的致病因子去除,達到舒緩症狀的效果,作為一種支持性療法,其運用的範圍由早期的腎臟病領域,擴展到嚴重創商、急性胰腺炎、全身性發炎症候群(SIRS)、人工肝支持療法、急性呼吸衰竭等輔助治療,並成為多重器官支持療法(Multiple Organ Support Therapy; MOST)中的重要一員。
血液淨化療法大致上可以分為連續性腎臟替代治療(Continuous Renal Replacement Therapy; CRRT)、血漿療法,以及較新的療法血漿濾過吸附(Coupled Plasma Filtration Adsorption; CPFA)。
 連續性腎臟替代治療 CRRT
連續性腎臟替代治療 CRRT
在加護病房中的病患,常有急性腎衰竭及多重器官衰竭情況發生,因大量輸液、血壓不穩定或顯著地心衰竭,並不適用於一般間歇性透析,連續性腎臟替代療法用來取代腎臟分泌功能,透過24小時不間斷的透析,採最小的血液流速及過濾液流速,能穩定血液動力學,移除毒素、水分、及維持血中酸鹼平衡[1]。CRRT的使用需考慮溶質清除率、補充液或透析液的形式、抗凝血劑、營養,以及藥物的劑量。實施此治療可移除大量的液體,視病患需求可持續執行療程數天到數週,較不會發生如傳統血液透析短期療法所發生的併發症。
CRRT作用的原理:
1. 擴散 Diffusion :
是一種溶質的運動,指水中溶質由濃度高往濃度低的地方移動,以達到兩邊濃度平衡。血液經過半通透膜時溶質會從血液中移動至透析液內。
2. 對流Convection:
血漿中的水分及特定溶質(依其分子量及過濾器膜孔的大小而定)藉由半透膜的壓力差而產生液體的流動,隨著液體流動帶動其他比半透膜孔洞小的分子,不受分子量與濃度差影響,因此,對流的優勢在於能移除大部分的溶質,包括一些細胞激素(cytokines),改善病患的發炎反應。
3. 超濾Ultrafiltration:
因泵浦推動造成壓力,因此在血液過濾器的內管為正壓,血液過濾器的外管為負壓,兩者的壓力差稱為跨膜壓(Trans-Membrane Pressure; TMP)。超濾的原理是將血液引入濾器後,單純依賴增加負壓,利用擴大跨膜壓達到清除水分和溶質的目的,這些離開血液過濾器液體室的液體稱為廢液。因為是等滲透脫水,不容易出現低血壓,但超濾量建議最好小於30 ml/Kg。
CRRT常見的療法:
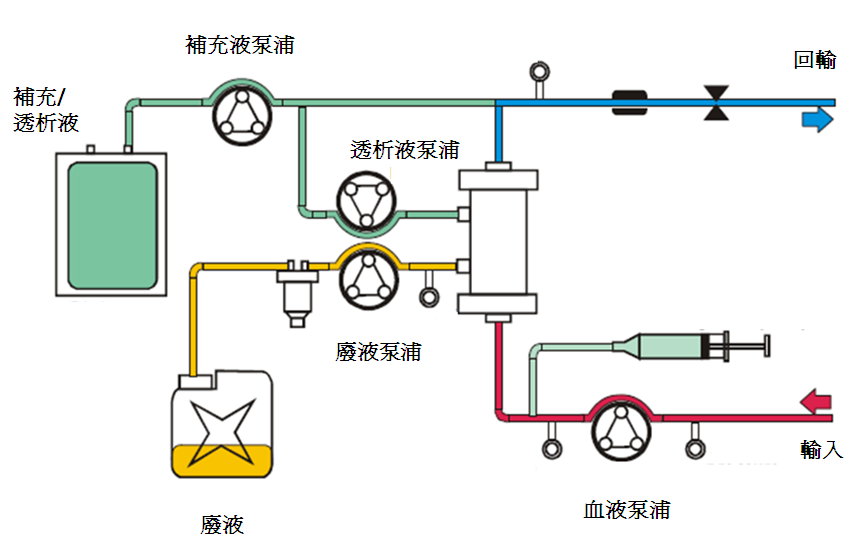
1. 連續靜靜脈血液過濾 (Continuous Veno-Venous Hemofiltration; CVVH)
連續靜靜脈血液過濾(continuous Venovenous Hemofiltration,CVVH)被定義成以適當的置換液,藉由半透膜的壓力差,部分或完全移除代謝廢物或電解質,以達到血液淨化或體液移除的技術。
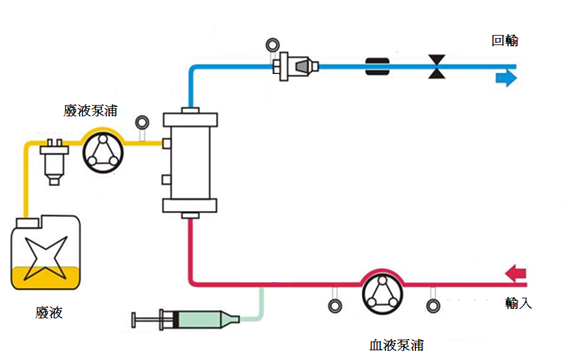
2. 連續靜靜脈血液透析(Continuous Veno-Venous Hemodialysis; CVVHD)
連續靜靜脈血液透析可以以擴散方式清除小的溶質。血液過濾器的流體室注入稱為透析液的溶液。
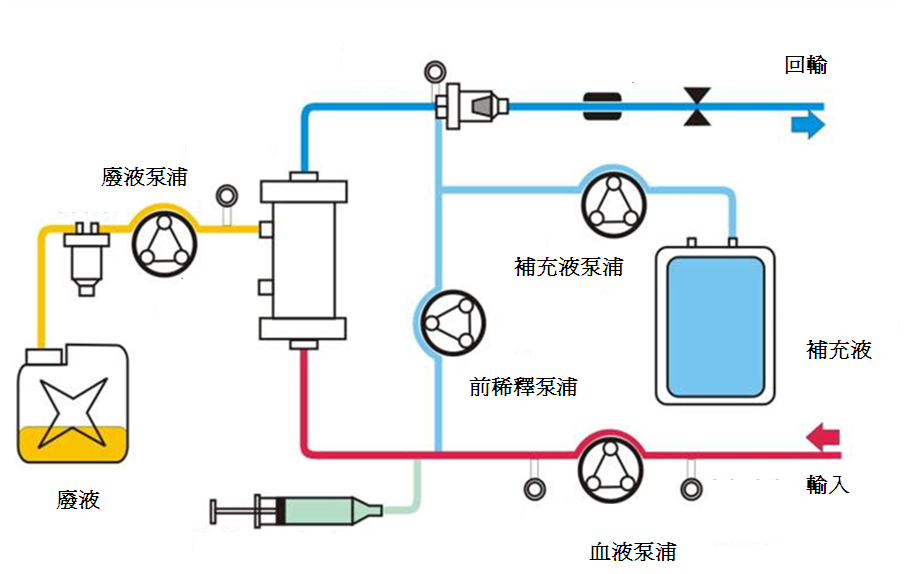
3. 連續靜靜脈血液透析濾過 (Continuous Veno-Venous Hemodiafiltration; CVVHDF)
連續靜靜脈血液透析過濾是同時以擴散及對流兩種方式來移除溶質。
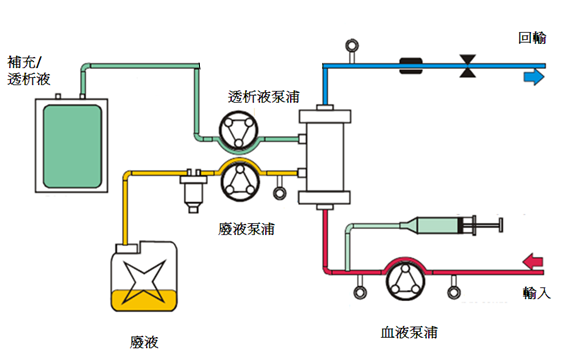
4. 緩慢連續超濾 (slow continuous u ltrafiltration; SCUF)
緩慢連續超濾預期的目標是將血漿中的水分與溶質利用超濾原理移除。
CRRT特點[2]
1. 對血流動力學的影響
優點爲緩慢、等滲透地清除水和溶質,容量波動小,滲透壓變化小,基本無輸液限制,能隨時調整液體平衡,從而改善血流動力學,符合人體生理狀況。在重症患者的治療中,連續性腎替代療法可保持穩定的平均動脈壓,利於腎功能的恢復,可提高生存率。
2. 對顱內壓的影響
嚴重神經創傷、神經外科手術及急性肝功能衰竭的病人,常常在發生腦水腫的同時,併發急性腎功能衰竭,可執行連續性腎替代療法保持顱內壓的穩定。
3. 控制氮質血症的模式與水準
連續性腎替代療法溶質清除率高,尿素清除率>30L/d(20ml/min),不易發生失衡現象。不僅能很好地控制氮血症,還能清除部分發炎物質,有利於急性腎功能衰竭或多重器官功能障礙、敗血症和心力衰竭患者。
4. 對水、電解質、酸鹼平衡的控制
連續性腎替代療法能緩慢、連續、等滲透地清除機體內的水分、溶質,同時能根據臨床需要,補充相關溶液及藥物,能有效而平穩地保持病人的水、電解質、酸鹼的平衡。
5. 營養支援治療
大多數急重症病患常有高分解狀態,加上消化吸收功能差,每日熱量攝入不足,常出現負氮平衡,每日分解自體蛋白質常在200克以上,容易導致氮血症發生和高鉀血症。連續性腎替代療法能透過大量液體緩慢、持續的攝入,進行營養支援治療,能確保每日的能量及各種營養物質的補充,並維持正氮平衡,利於病人的恢復。
6. 支援ECMO
接受葉克膜體外維生系統(Extracorporeal Membrane Oxygenation; ECMO)治療的病人,常伴隨急性腎損傷,此時可搭配CRRT進行治療。研究指出,CRRT結合ECMO的治療方式是安全有效的,能提高體液平衡,改善電解質失衡。
 血漿療法
血漿療法
血漿療法係指先將患者的血液從身體引流出,再從血液分離出血漿,對於血漿可以採用移除、吸附、濾過等不同方式,將血漿中的致病因子移除,達到治療疾病的目的。這些移除物質都通常是一般血液過濾、血液透析較難移除的大分子,例如免疫複合物、膽固醇等。
治療時必須考慮致病物質的種類、病情的嚴重程度、在血管內及細胞間質中的分布比例,同時考量分子反彈速度以及體內新生成病理性的物質,來決定單次治療的血漿量與每次治療的間隔時間與頻度[3]。
血漿療法介紹
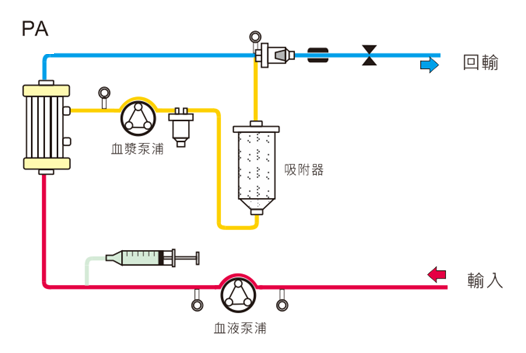
1. 血漿置換術 (Plasma Exchange; PE)
血漿置換術是將由血漿分離器分離出來的血漿全部排除棄去,代以置換同等量的新鮮冷凍血漿(Fresh Frozen Plasma; FFP)或白蛋白溶液等以達到治療目的。
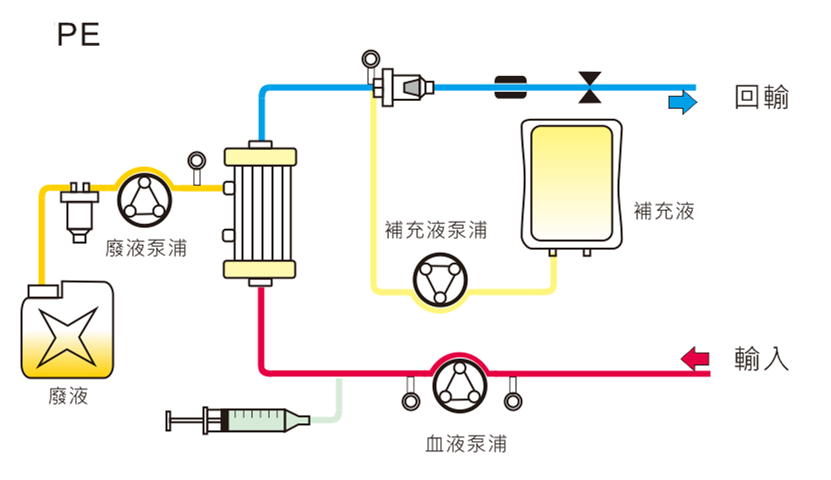
2. 雙重過濾血漿分離術 (Double Filtration Plasmapheresis; DFPP)
雙重過濾血漿分離術是利用血漿分離器,將血漿從全血中分離出來後,再透過血漿成份分離器,移除血漿中的大分子量的致病物質,其他中小分子與血漿會與血球一起合併送回病人體內。執行療程時,白蛋白仍有可能會丟失,因此需要監測患者的白蛋白濃度,若患者白蛋白丟失過多造成濃度下降過快時,需回補白蛋白或相關血液製劑。HF440具有FLUSH系統,當血液成份分離器的跨膜壓達到設定值時,透過生理食鹽水沖洗血液成份分離器,將大分子的致病因子沖至廢液,延長血液成份分離器壽命,並且回推血漿,降低白蛋白損失。
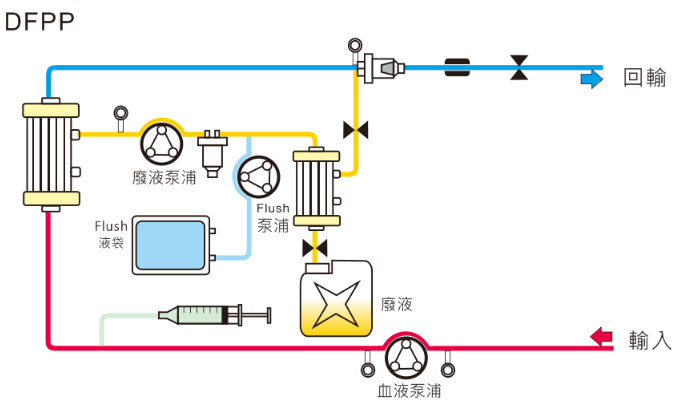
3. 血漿吸附術 (Plasma Adsorption; PA)
若要移除特定類型的致病因子,可利用特異性吸附方式移除致病因子,選用專用地吸附器,才能針對血漿做一個特異性吸附,移除血漿中異常物質,由於此方法較不會造成白蛋白等血漿有用的成分丟失,療程後不需要另行給予補充液,只需依據不同的疾病需求,選擇特定的吸附器。
血漿療法適應症
血漿療法運用範圍十分廣泛,常用於先天免疫疾病,主要針對常見的適應症作介紹
1. 全身性紅斑狼瘡(Systemic Lupus Erythematosus; SLE)
SLE致病機制尚未清楚,但可能由基因、抗體、內分泌、環境因子等複雜的交互反應所導致。人體會產生專一性抗體,這些抗體會攻擊自身人體,導致SLE。症狀為蝴蝶疹、頭痛、掉髮、貧血、嚴重疲勞等等。
目前治療方式有使用皮質類固醇、免疫抑制劑等藥物,此外透過血漿置換術與雙重過濾血漿分離術進行治療,將這些抗體與其免疫複合物移除,改善病人病況。
2. 血栓性血小板減少性紫癜 (Thrombotic Thrombocytopenic purpura; TTP)
TTP致病機制尚未清楚,其特徵為微血管血小板聚集,導致血小板減少和血細胞減少性血液溶血性貧血,常伴有器官功能障礙,神經異常,腎功能衰竭和發燒。自從1991年來,以血漿置換術為第一線治療TTP,其他血將療法如雙重過濾血漿分離術,無法補充ADAMTS 13酵素與其他凝血因子。血漿置換術透過補充新鮮冷凍血漿或其他血漿製品,但必須監控因補充血漿製品所產生的併發症。
3. 人工肝支持療法 (Artificial liver support)
血漿療法應用於人工肝支持療法,最廣泛採用的是血漿置換術,臨床上,透過移除患者血漿,來去除蓄積的毒素如膽紅素等,同時補充外來的血漿,其中含有充足的白蛋白與凝血因子,補充患者血漿中不足的血漿蛋白與凝血因子。對於水溶性中小分子的毒素移除,臨床上常使用血漿置換術結合連續靜靜脈血液過濾(CVVH)共同治療,透過連續靜靜脈血液過濾清除水溶性毒素與代謝毒素,並穩定血液動力學、酸鹼平衡、補充電解質與調整體液等。
血漿療法併發症
血漿置換由於會使用到新鮮冷凍血漿(FFP)、或白蛋白等做為補充液,而FFP中含有檸檬酸鈉作為抗凝血劑,檸檬酸鈉會與鈣離子結合,而導致血鈣濃度的降低,導致低血鈣,讓病患發生四肢麻痺、甚至痙攣。輸注FFP也容易引起過敏、發燒、發冷、蕁麻疹、搔癢等併發症,嚴重時可能導致輸血性急性肺損傷、非心因性肺水腫。此外,注意回補的體積是否足夠,補充液體積不足,容易導致病患產生低血壓的情況。
因此,考量到血漿置換所導致的併發症,某些病人改採用雙重過濾血漿分離術移除血漿中的致病因子,以降低回補血漿製品。雙重過濾術的併發症一般都比較輕微,少部分患者會有低血壓、暈眩或頭暈等情況,雙重過濾血漿分離術能降低回補血漿製品,但療程過程中仍會丟失白蛋白,因此必須監控白蛋白數值,過低時,應回補白蛋白降低併發症的風險。
 血漿濾過吸附(Coupled Plasma Filtration Adsorption; CPFA)
血漿濾過吸附(Coupled Plasma Filtration Adsorption; CPFA)
CPFA先利用血漿分離原理分離血漿,再以吸附器吸附致病因子物質(如:發炎物質、膽紅素、肌紅蛋白等),同時執行腎臟替代療法清除水溶性中、小分子的合併性療法。
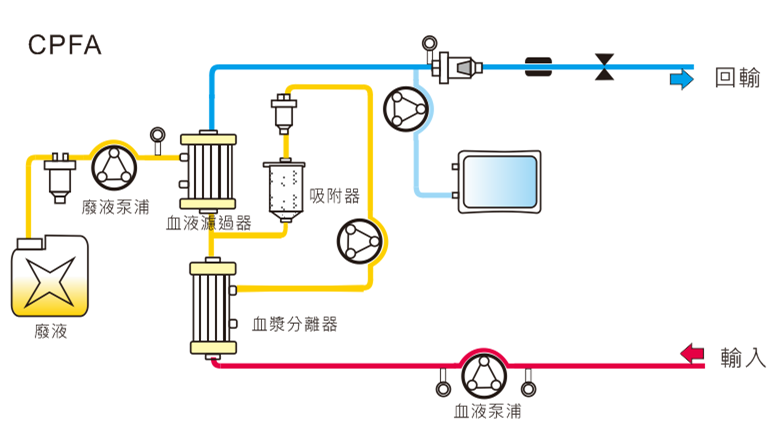
CPFA在1990年代已開始發展,為了移除這些難以去除的細胞激素與毒素,在國外施行已超過10年,是一個發展成熟且安全有效的療法。CPFA吸附器的吸附劑是由聚苯乙烯樹脂微粒(平均直徑128µm,孔徑30nm)所組成,吸附表面積可達到70,000平方公尺,遠高於一般的血液濾器(1.4 - 2平方公尺)。吸附的原理主要透過樹脂親和力、凡得瓦力、親疏水性,因此能進行非特異性吸附,即非特定吸附單一物質,主要能吸附細胞激素、膽紅素、補體。
 |
 |
 |
| A | B | C |
樹脂微粒。CPFA透過樹脂微粒(A)進行吸附,由於樹脂微粒上具有許多孔洞(B),物質從孔洞中進入樹脂微粒,進而因親和力、凡得瓦力吸附移除。
常見適應症
使用CPFA最初是為了治療敗血症和敗血性休克而開發,但隨著研究發展,新的應用也不斷被探討發表,包括肝衰竭、(創傷性)橫紋肌溶解症、severe autoimmune exacerbation 和中毒,均是利用移除過量的細胞激素、膽紅素、或是特異大分子等,讓病人體內有害因子降低,發炎情況減緩,降低器官衰竭的機率,讓醫護人員有時間發掘病因並針對病因來治療,有利後續的治療。
1. 敗血症
當病人體內具有異常高的發炎前物質與發炎物質,這些發炎的訊號,會導致細胞與組織處在發炎的情況,長時間下來會導致細胞與組織受損,若無法改善便會發展為全身性發炎症候群,嚴重時可導致敗血症,敗血症常導致器官受損甚至衰竭,具有很高的死亡率。通常敗血症病人的肝腎臟代謝功能不佳,尤其是併發多重器官衰竭的病人,更難以移除這些大量快速新增的發炎物質。使用CPFA將這些發炎物質吸附移除,降低敗血症病人的發炎情況,減少細胞組織因發炎導致的傷害。除了發炎物質外,臨床上,敗血症病人通常由於腎臟功能損傷對於中小分子廢物的代謝也不佳,透過CPFA中的血液濾過技術,移除中小分子廢物,並且穩定血液動力學、維持血中酸鹼平衡、或是給予營養。
2. 人工肝支持療法
肝功能不佳的病人,或是肝衰竭的人,本身難以代謝膽紅素等毒素,累積在病人體內,會導致細胞組織受損,因此臨床上透過移除膽紅素等毒素來治療,但是膽紅素本身能與血液中白蛋白結合,變成分子量極大的複合物,不易透過血液濾過或是血液透析移除,所以逐漸發展出吸附療法來移除膽紅素。CPFA原本主要針對嚴重敗血症與敗血症休克,目前的吸附器本身除了可以吸附發炎介質,臨床上也顯示對膽紅素等毒素有28-53%的吸附能力,所以臨床上進行CPFA吸附膽紅素等毒素,改善高膽紅素病人症狀,也能作為人工肝支持療法。除了有效降低膽紅素的濃度外,CPFA能吸附色胺酸(Tryptophan)與苯酚(Phenol)毒素(肝性腦病相關的虛假神經傳遞物),降低肝性腦病變(Hepatic encephalopathy)機率。
3. 其他疾病
最近有研究發表運用CPFA治療橫紋肌溶解性腎移植兩名患者,肌紅蛋白的濃度均顯著下降,病人改善許多發炎參數(例如CRP)[22]。此外,另外一篇研究運用CPFA治療4例創傷性橫紋肌溶解的急性腎損傷病人,觀察到CPFA療程結束後,這四名病人的肌紅蛋白和肌酐激酶(creatinine kinase)均顯著下降,並且腎功能也改善。顯示CPFA能安全有效運用於橫紋肌溶解症,改善腎臟功能。
此外,CPFA也用於治療非常複雜的病例,一名77歲女性在接踵Guillain-Barre疫苗後產生併發症,該名患者先是接受IV免疫球蛋白治療,但仍然產生高燒、心臟驟停、敗血性休克、血液動力學不穩。進行CPFA治療後,發炎指數與D-Dimer顯著改善,認為CPFA對於敗血性休克與發炎性脫髓鞘性多發性神經病(inflammatory demyelinising polyneuropathy)有所改善效果。
除了上述疾病外,也有研究CPFA能吸附游離三碘甲狀腺素(FT3)和游離甲狀腺素(FT4),表示CPFA能運用的範圍,隨著研究的發展,能越來越多,後續還需要更多的研究。
處理血漿量
執行CPFA療法時,必須考量到實際執行處理的血漿量,在臨床試驗中分析發現,當CPFA處理的血漿量達到0.20 L/kg/day以上並且連續執行至少三天時,相對於接受傳統治療之控制組或執行CPFA但處理血漿量低的病人,其死亡率呈現下降趨勢。此外,先前的研究也顯示當療程進行時,若因血液凝固導致血漿分離器阻塞,療程將被迫中止,將可能導致處理的血漿量無法達到治療建議值。因CPFA要有好的治療成效,處理的血漿量就要達到有效的治療劑量,所以血液抗凝技術的選擇及應用便是一個重要關鍵。
參考文獻:
1. Dirkes, S. and K. Hodge, Continuous renal replacement therapy in the adult intensive care unit: history and current trends. Crit Care Nurse, 2007. 27(2): p. 61-6, 68-72, 74-80; quiz 81.
2. 新編實用血液淨化手冊. 2019: cai jia zhang.
3. Kaplan, A.A., Therapeutic plasma exchange: a technical and operational review. J Clin Apher, 2013. 28(1): p. 3-10.
